Podes Copperplate?
Esta lección explora a enxeñaría química e como os procesos de revestimento químico e galvanoplastia afectaron a moitas industrias. Os alumnos traballan en equipo para facer unha placa de cobre cunha serie de elementos empregando materiais cotiáns.
- Coñece o deseño e o deseño de enxeñaría.
- Coñece a enxeñaría química.
- Coñece como a enxeñaría pode axudar a resolver os desafíos da sociedade.
- Coñece o traballo en equipo e a resolución de problemas.
Niveis de idade 12-18
Nota de seguridade:
Que os alumnos leven luvas de goma cando eliminen os materiais da solución ou cando se eliminan a solución. Esta actividade debe facerse nunha zona ben ventilada xa que a solución pode desprender un cheiro despois do proceso de revestimento.
- Non empregue moedas valiosas, xa que o acabado verase alterado e pode afectar o valor da moeda de colección.
- Os estudantes non deben beber o zume de limón nin a solución de vinagre nin antes nin despois de mergullar as moedas.
Construír materiais (para cada equipo)
Materiais requiridos (por equipo)
- Luvas de goma
- Frascos de vidro (os vasos de conservas ou conservas funcionan ben)
- 25 céntimos, euros ou calquera outra moeda con revestimento de cobre
Materiais requiridos (táboa de posibilidades)
- Cravos de ferro, parafusos ou parafusos (non galvanizados)
- Sal
- Vinagre branco / claro
- Zume de limón
- zume de laranxa
- Bicarbonato de sodio
- Fregadero
- Auga
Proba de materiais
- Luvas de goma
- Fonte de auga
- Cubeta ou lavabo
- Centos de céntimos sucios, euros ou outras moedas ou materiais cun alto contido superficial de cobre
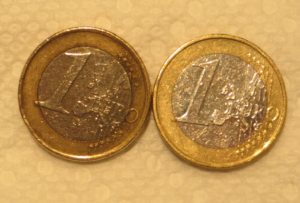
Obras
- Luvas de goma
- Fonte de auga
- Cubeta ou lavabo
- Centos de céntimos sucios, euros ou outras moedas ou materiais cun alto contido superficial de cobre

Proceso
Varios métodos terán éxito eliminando unha capa de cobre dos céntimos ou outros elementos da superficie de cobre e transferindo o cobre a outro elemento metálico. Vexa a continuación unha solución suxerida. Considere se quere proporcionar estes métodos aos equipos ou se desexa que os equipos presenten unha solución por si mesmos. Asegúrese de revisar e supervisar TODAS as solucións desenvolvidas por seguridade.
- Solución:
- Poña 25 céntimos (ou outras moedas ou materiais con alto contido de cobre externo) nun frasco de vidro con 1/2 cunca (125 ml) de vinagre branco e 1/4 cucharadita (1 ml) de sal.
- Deixe repousar a solución durante 5 minutos e logo engade un cravo de ferro, un parafuso ou outro elemento (non galvanizado) durante outros 5 minutos.
- Elimina o elemento de ferro e usa unha almofada para eliminar parte do revestimento e colócao de novo no frasco.
- Engade as moedas e deixa repousar a solución durante 15 minutos.
- As moedas deben ser brillantes e o elemento de ferro debe ter un fino revestimento de cobre.
Elimine as solucións nunha pía (é probable que teñan un cheiro forte). Se os céntimos non se aclaran en auga despois da proba, converteranse en azul azul despois duns días.
Deseño Challenge
Formas parte dun equipo de enxeñeiros dado o reto de aplicar unha superficie de cobre a outro metal. Podes escoller o (s) elemento (s) metálico (s) que desexas pratar e tamén a solución química e o tempo que cres que funcionarán mellor. Desenvolverás dous métodos diferentes e verás cal funciona mellor.
Criterios
- Debe desenvolver dous métodos de revestimento de cobre diferentes
- Debe usar un recipiente de vidro
Restriccións
- Use só os materiais proporcionados
- Break clase en equipos de 2-4.
- Entrega a folla de traballo Can You Copperplate, así como algunhas follas de papel para debuxar debuxos.
- Debate sobre os temas na sección Conceptos de fondo. Considere mostrar aos estudantes varios parafusos ou cravos con acabados diferentes e pregúntelles por que se fabrican diferentes acabados.
- Revise o proceso de deseño de enxeñaría, o desafío de deseño, os criterios, as restricións e os materiais.
- Proporcionar a cada equipo os seus materiais.
- Explica que os estudantes deben desenvolver dous plans diferentes para cubrir un dos seus elementos. Poden empregar diferentes solucións, materiais, tempos, etc. Cada un debe empregar céntimos máis vellos, euros ou outras moedas ou materiais con alto contido externo de cobre e usar un recipiente de vidro.
- Paso 1: Identifique os elementos e determine dous métodos para recubrirlos en cobre. Pode querer considerar colocar varios elementos nunha das solucións. Pero debes ter en conta que calquera cobre liberado dos céntimos ou outras moedas a base de cobre diluirase despois entre varios elementos metálicos. Documenta o seguinte para cada unha das dúas solucións:
- Describe a solución (inclúe a cantidade de cada elemento que se incluirá
- Describe os elementos que se van chapar
- Describir o método (sincronización, métodos de aclarado, etc.)
- Resultado previsto
- Paso 2: Presente o plan e o resultado previsto á clase. Considera as ideas doutros equipos e axusta o teu plan, se queres.
- Paso 3: Proba os dous métodos e anota as túas observacións para cada un:
- Que pasou coa solución?
- Que pasou cos elementos que intentabas pratar?
- Que pasou cos céntimos ou as pezas / moedas de cobre?
- ¿Funcionou este método?
- Anuncia o tempo que teñen para completar o Paso 1 (recoméndase 1 hora).
- Use un temporizador ou un cronómetro en liña (función de conta atrás) para asegurarse de manter o tempo. (www.online-stopwatch.com/full-screen-stopwatch). Dálles aos estudantes "controis de tempo" regulares para que poidan seguir a tarefa. Se están loitando, faga preguntas que os leven a unha solución máis rápido.
- Os estudantes reúnense e desenvolven un plan. Coinciden en materiais e métodos.
- Os equipos completan a planificación do Paso 1.
- Os equipos completan a presentación do Paso 2.
- Os equipos completan as probas e observacións do Paso 3. Consulte a sección "Materiais e procesos de ensaio".
- Por que funciona este proceso?
- A mestura de vinagre e sal crea unha solución ácida. O óxido de cobre disólvese cando se expón á solución.
- Os materiais de ferro están revestidos de cobre porque cando os céntimos están na solución parte do cobre da superficie disolverase. Pero cando os átomos de cobre deixan o céntimo, deixan algúns dos seus electróns atrás ... ións de cobre realmente cargados positivamente (átomos de cobre aos que lles faltan dous electróns).
- Parte do metal do ferro disólvese e hai ións de ferro con carga positiva que flotan na solución cos ións de cobre con carga positiva. Cando os ións de ferro deixan o cravo / parafuso, o elemento queda cargado negativamente e atrae así os ións cargados positivamente na solución.
- Os ións de cobre son máis atraídos polo elemento de ferro que os átomos de ferro, polo que revisten o elemento cun fino revestimento de cobre.
- Como clase, debate sobre as preguntas de reflexión do alumno.
- Para obter máis contido sobre o tema, consulte a sección "Máis profundo".
Reflexión do estudante (caderno de enxeñaría)
- ¿Foi capaz o seu equipo de chapear un elemento de metal? Que factores cres que contribuíron ao éxito ou ao fracaso do teu método?
- Se atopaches que necesitabas facer cambios no teu método despois de escoitar os métodos planificados por outros equipos, describe por que o teu equipo decidiu facer revisións.
- Que método adoptou outro equipo foi o máis exitoso? Por que cres que funcionou tan ben este método?
- Cres que esta actividade foi máis gratificante facela en equipo ou terías preferido traballar só nela? Por que?
- Cres que os enxeñeiros químicos teñen que facer moitos intentos para acadar un obxectivo? Como cres que sería fallar unha e outra vez antes de ter éxito?
- Que industria ou negocio cres que pode querer usar o método que desenvolveu?
Modificación do tempo
A lección pódese facer en tan só 1 período de clase para estudantes maiores. Non obstante, para evitar que os estudantes se sintan apresurados e para garantir o éxito dos estudantes (especialmente para os máis novos), divida a lección en dous períodos dándolle aos estudantes máis tempo para facer unha pluja de ideas, probar ideas e finalizar o seu deseño. Realice as probas e o resumo no seguinte período de clases.
Procesos de revestimento

Chapado en metal
O revestimento de metais fíxose mediante moitos procesos desde a antigüidade. O chapado en ouro é un método para depositar unha fina capa de ouro sobre a superficie doutro metal, a maioría das veces cobre ou prata (para facer dourado de prata), mediante recubrimento químico ou electroquímico. O galvanoplastia ten moitos usos ... pode facer que un material sexa máis resistente a danos ou abrasións ... pode facer que un material pareza máis agradable ... endurecer unha superficie ... reducir a fricción ... mellorar a adherencia da pintura, alterar a condutividade e protexer contra a radiación , e para outros fins. Tamén se usa para acumular o espesor de pezas de pequeno tamaño. É amplamente utilizado na industria para recubrir obxectos metálicos cunha fina capa dun metal diferente. A capa de metal depositada ten algunha propiedade desexada, da que carece o metal do obxecto. Por exemplo, o cromado realízase en moitos obxectos como pezas de automóbiles, billas de baño, queimadores de gas de cociña, llantas e moitos outros. O ouro adoita chaparse en prata ou nun metal menos caro para reducir o custo das xoias. O chapado en ouro úsase a miúdo na electrónica para proporcionar unha capa eléctricamente resistente á corrosión sobre cobre, normalmente en conectores eléctricos e placas de circuítos impresos. A superficie das uñas empregadas na construción ás veces é galvanizada o que engade unha capa de cinc.

Que é o galvanoplastia?
O galvanoplastia é un proceso no que os ións metálicos nunha disolución son movidos por un campo eléctrico para revestir un electrodo. O proceso usa corrente eléctrica para revestir un obxecto condutor cunha fina capa do material, como un metal. O proceso empregado na galvanoplastia chámase electrodeposición. Nunha técnica, o ánodo está feito do metal que se chapa na peza. Ambos compoñentes están inmersos nunha solución chamada electrólito que contén un ou máis sales metálicos disoltos, así como outros ións que permiten o fluxo de electricidade. Unha fonte de alimentación subministra unha corrente continua ao ánodo, oxidando os átomos metálicos que o compoñen e permitíndolles disolverse na solución.
No cátodo, os ións metálicos disoltos na solución de electrólito redúcense na interfase entre a solución e o cátodo, de forma que se "chacan" sobre o cátodo. A velocidade á que se disolve o ánodo é igual á velocidade á que se chapa o cátodo, fronte á corrente que circula polo circuíto. Deste xeito, os ións do baño de electrólitos son reabastecidos continuamente polo ánodo. No exemplo da dereita, nunha disolución ácida, o cobre oxídase no ánodo a Cu2+ ao perder dous electróns. O Cu2+ asóciase co anión SO42- na solución para formar sulfato de cobre.
- Químico: Calquera substancia (como ácido) que se forma cando dúas ou máis substancias actúan unha sobre a outra ou que se usa para producir un cambio noutra substancia.
- Limitacións: limitacións de material, tempo, tamaño do equipo, etc.
- Cobre: metal marrón avermellado que é un dos elementos químicos
- Copperplate: Aplicación dunha superficie de cobre a outro metal.
- Criterios: Condicións que debe cumprir o deseño como o seu tamaño global, etc.
- Enxeñeiros: inventores e solucionadores de problemas do mundo. Recoñécense vintecinco grandes especialidades en enxeñaría (ver infografía).
- Proceso de deseño de enxeñería: os enxeñeiros de procesos usan para resolver problemas.
- Engineering Habits of Mind (EHM): Seis formas únicas de pensar os enxeñeiros.
- Iteración: probar e redeseño é unha iteración. Repetir (múltiples iteracións).
- Prototipo: un modelo de traballo da solución que se vai probar.
- Solución: mestura de dúas ou máis substancias que se mantén uniformemente mesturadas.
[/ vc_column_text]
Conexións a Internet
Lectura recomendada
- Manual de Enxeñaría de Galvanoplastia (ISBN: 978- 1475708561)
- O pulido e o revestimento de metais (ISBN: 978-1246867176)
- Electrodeposición de metais (ISBN: 978- 1176590250)
Actividade escrita
Escribe un ensaio ou un parágrafo sobre por que se galvanizan as uñas empregadas na construción.
Aliñación aos marcos curriculares
Nota: Os plans de lección desta serie están aliñados a un ou máis dos seguintes conxuntos de estándares:
- Normas de educación científica dos EUA (http://www.nap.edu/catalog.php?record_id=4962)
- Normas científicas de próxima xeración dos EUA (http://www.nextgenscience.org/)
- Normas de alfabetización tecnolóxica da International Technology Education Association (http://www.iteea.org/TAA/PDFs/xstnd.pdf)
- Principios e estándares para as matemáticas escolares do Consello Nacional dos Profesores de Matemáticas dos EUA (http://www.nctm.org/standards/content.aspx?id=16909)
- Normas estatais comúns comúns dos Estados Unidos para matemáticas (http://www.corestandards.org/Math)
- Asociación de Profesores de Informática K-12 Normas de Informática (http://csta.acm.org/Curriculum/sub/K12Standards.html)
Normas nacionais de educación científica Graos K-4 (idades 4-9)
ESTÁNDAR DE CONTIDO A: a ciencia como investigación
Como resultado das actividades, todos os estudantes deberían desenvolverse
- Capacidades necesarias para facer investigación científica
- Comprensión sobre a investigación científica
ESTÁNDAR DE CONTIDO B: Ciencia Física
Como resultado das actividades, todos os estudantes deben comprender
- Propiedades de obxectos e materiais
ESTÁNDAR DE CONTIDO D: Ciencia da Terra e do Espazo
Como resultado das súas actividades, todos os estudantes deben comprender
- Propiedades dos materiais terrestres
ESTÁNDAR DE CONTIDO E: Ciencia e Tecnoloxía
Como resultado das actividades, todos os estudantes deberían desenvolverse
- Capacidades de deseño tecnolóxico
- Comprensión sobre ciencia e tecnoloxía
ESTÁNDAR DE CONTIDO F: Ciencia en perspectivas persoais e sociais
Como resultado das actividades, todos os estudantes deben comprender
- Tipos de recursos
- Ciencia e tecnoloxía nos retos locais
ESTÁNDAR DE CONTIDO G: Historia e natureza da ciencia
Como resultado das actividades, todos os estudantes deben comprender
- A ciencia como un esforzo humano
Normas nacionais de educación científica 5-8 anos (10-14 anos)
ESTÁNDAR DE CONTIDO A: a ciencia como investigación
Como resultado das actividades, todos os estudantes deberían desenvolverse
- Capacidades necesarias para facer investigación científica
ESTÁNDAR DE CONTIDO B: Ciencia Física
Como resultado das súas actividades, todos os estudantes deben comprender
- Propiedades e cambios de propiedades na materia
ESTÁNDAR DE CONTIDO E: Ciencia e Tecnoloxía
Como resultado das actividades dos 5-8 graos, todos os estudantes deberían desenvolverse
- Capacidades de deseño tecnolóxico
ESTÁNDAR DE CONTIDO F: Ciencia en perspectivas persoais e sociais
Como resultado das actividades, todos os estudantes deben comprender
- Ciencia e tecnoloxía na sociedade
Normas nacionais de educación científica 5-8 anos (10-14 anos)
ESTÁNDAR DE CONTIDO G: Historia e natureza da ciencia
Como resultado das actividades, todos os estudantes deben comprender
- A ciencia como un esforzo humano
- Historia da ciencia
Normas nacionais de educación científica 9-12 anos (14-18 anos)
ESTÁNDAR DE CONTIDO A: a ciencia como investigación
Como resultado das actividades, todos os estudantes deberían desenvolverse
- Capacidades necesarias para facer investigación científica
ESTÁNDAR DE CONTIDO B: Ciencia Física
Como resultado das súas actividades, todos os estudantes deben comprender
- Reaccións químicas
- Estrutura e propiedades da materia
ESTÁNDAR DE CONTIDO E: Ciencia e Tecnoloxía
Como resultado das actividades, todos os estudantes deberían desenvolverse
- Capacidades de deseño tecnolóxico
- Comprensión sobre ciencia e tecnoloxía
ESTÁNDAR DE CONTIDO F: Ciencia en perspectivas persoais e sociais
Como resultado das actividades, todos os estudantes deben comprender
- Recursos naturais
- Ciencia e tecnoloxía nos retos locais, nacionais e globais
ESTÁNDAR DE CONTIDO G: Historia e natureza da ciencia
Como resultado das actividades, todos os estudantes deben comprender
- A ciencia como un esforzo humano
- Perspectivas históricas
Estándares de ciencia de nova xeración: 2o e 5o grao (7-11 anos)
A materia e as súas interaccións
- 2-PS1-2. Analiza os datos obtidos da proba de diferentes materiais para determinar que materiais teñen as propiedades máis adecuadas para o propósito previsto.
Deseño de enxeñaría
Os estudantes que demostren comprensión poden:
- 3-5-ETS1-1.Define un problema de deseño sinxelo que reflicta unha necesidade ou un desexo que inclúa criterios específicos de éxito e restricións de materiais, tempo ou custo.
- 3-5-ETS1-2.Xerar e comparar múltiples solucións posibles a un problema en función do ben que cada un cumpra os criterios e as restricións do problema.
- 3-5-ETS1-3.Planifica e realiza probas xustas nas que se controlan as variables e se consideran os puntos de falla para identificar aspectos dun modelo ou prototipo mellorables.
Estándares de ciencia de nova xeración: 6o e 8o grao (11-14 anos)
A materia e as súas interaccións
- MS-PS1-2. Analizar e interpretar datos sobre as propiedades das substancias antes e despois de que as substancias interactúen para determinar se se produciu unha reacción química.
Deseño de enxeñaría
Os estudantes que demostren comprensión poden:
- MS-ETS1-1. Definir os criterios e as restricións dun problema de deseño con suficiente precisión para garantir unha solución exitosa, tendo en conta os principios científicos relevantes e os impactos potenciais sobre as persoas e o medio natural que poden limitar as posibles solucións.
- MS-ETS1-2. Avaliar solucións de deseño competitivas mediante un proceso sistemático para determinar o ben que cumpren os criterios e as restricións do problema.
Normas para a alfabetización tecnolóxica - Todas as idades
A natureza da tecnoloxía
- Norma 1: os estudantes desenvolverán unha comprensión das características e alcance da tecnoloxía.
- Estándar 3: os estudantes desenvolverán unha comprensión das relacións entre as tecnoloxías e as conexións entre a tecnoloxía e outros campos de estudo.
Tecnoloxía e Sociedade
- Estándar 4: os estudantes desenvolverán unha comprensión dos efectos culturais, sociais, económicos e políticos da tecnoloxía.
- Norma 6: os estudantes desenvolverán unha comprensión do papel da sociedade no desenvolvemento e uso da tecnoloxía.
- Estándar 7: os estudantes desenvolverán unha comprensión da influencia da tecnoloxía na historia.
Proxecto
- Estándar 8: os estudantes desenvolverán unha comprensión dos atributos do deseño.
- Norma 9: os estudantes desenvolverán unha comprensión do deseño de enxeñaría.
- Norma 10: os estudantes desenvolverán unha comprensión do papel da resolución de problemas, investigación e desenvolvemento, invención e innovación e experimentación na resolución de problemas.
Habilidades para un mundo tecnolóxico
- Norma 11: os estudantes desenvolverán habilidades para aplicar o proceso de deseño.
- Norma 13: os estudantes desenvolverán habilidades para avaliar o impacto de produtos e sistemas.

Planificación e traballo en equipo de enxeñaría
Formas parte dun equipo de enxeñeiros dado o reto de aplicar unha superficie de cobre a outro metal. Podes escoller o elemento / elementos de metal que desexas pratar e tamén a solución química e o tempo que cres que funcionarán mellor. Desenvolverás dous enfoques diferentes e verás cal funciona mellor.
Paso 1: determine dous métodos para o revestimento de cobre e identifique os seus elementos. Teña en conta que quizais desexe considerar colocar varios elementos nunha das solucións ... pero ten en conta que calquera cobre liberado dos céntimos ou outras moedas a base de cobre diluirase entre varios elementos metálicos e, polo tanto, é posible que non vexas resultados. No cadro de abaixo, describe a túa solución, método, tempo e elementos que farás de cobre.
| solución | Describe a solución (inclúe a cantidade de cada elemento que incluirás) | Describe os elementos que se van chapar | Describir o método (incluídos os tempos, os métodos de aclarado, etc.) | Resultado previsto |
| 1 |
|
|||
| 2 |
|

Presentación e probas
Paso 2: Presente o plan e o resultado previsto na clase. Considere as ideas dos outros equipos e axuste o seu plan se o desexa.
Paso 3: proba os teus dous métodos e anota as túas observacións no cadro seguinte.
| solución | Que pasou coa solución? | Que lle pasou ao elemento que intentabas pratar? | Que pasou cos céntimos ou as pezas / moedas de cobre? | ¿Funcionou este método? |
| 1 |
|
|||
| 2 |
|

Reflexión
Completa as preguntas de reflexión a continuación:
- ¿Foi capaz o seu equipo de chapear un elemento de metal? Que factores cres que contribuíron ao éxito ou ao fracaso do teu método?
- Se atopaches que necesitabas facer cambios no teu método despois de escoitar os métodos planificados por outros equipos, describe por que o teu equipo decidiu facer revisións.
- Que método adoptou outro equipo foi o máis exitoso? Por que cres que funcionou tan ben este método?
- Cres que esta actividade foi máis gratificante facela en equipo ou terías preferido traballar só nela? Por que?
- Cres que os enxeñeiros químicos teñen que facer moitos intentos para acadar un obxectivo? Como cres que sería fallar unha e outra vez antes de ter éxito?
- Que industria ou negocio cres que pode querer usar o método que desenvolveu?




 Enxeñaría industrial
Enxeñaría industrial
 Enxeñaría informática
Enxeñaría informática